Sysmex se vuelve rosa: luchemos juntos contra el cáncer de mama
El cáncer de mama es el tipo de neoplasia maligna que se diagnostica con más frecuencia en las mujeres [1]. Sin embargo, la detección temprana a través de exámenes regulares y pruebas genéticas para determinar la predisposición de uno puede aumentar las posibilidades de que esta enfermedad sea curable y, en varios casos, evitable.
Además, la aplicación de nuevas herramientas de diagnóstico molecular combinadas con enfoques quirúrgicos menos invasivos y tratamientos personalizados han mejorado significativamente el resultado oncológico y la calidad de vida de la paciente.
Desempeñamos un papel importante en estas mejoras, ofreciendo una amplia cartera de productos de vanguardia que abarcan todo el proceso de gestión del cáncer de mama.
Métodos de prevención del cáncer de mama
En la mayoría de los casos, el cáncer de mama hereditario se debe a la presencia de una mutación deletérea de la línea germinal (heredada) en los genes BRCA1 y/o BRCA2 [2].
Antes de la prueba, la paciente tiene una evaluación de riesgo, en la que se reunirá con un asesor genético u otro profesional de la salud de atención médica para revisar varios factores, como de si sus familiares han tenido cáncer, qué tipo de cáncer y en qué edades fueron diagnosticados. Si la evaluación sugiere que la paciente tiene un mayor riesgo de portar una variante del gen BRCA1 o BRCA2 dañino, el asesor genético puede solicitar una prueba genética, eso siempre si la paciente quiere someterse a tal prueba.
A continuación, se encuentran las recomendaciones propuestas por la NCCN para las pruebas BRCA1 y BRCA2 [3]:
- Diagnóstico de cáncer de mama a la edad de ≤ 45 años
- Cánceres de mama múltiples: bilateral o ipsilateral
- Cáncer de mama y de ovario a cualquier edad
- Cáncer de mama masculino
- Cáncer de mama triple negativo (receptor de estrógeno negativo, receptor de progesterona negativo y HER2/ neu negativo) diagnosticado ≤ 60 años)
- Cáncer de páncreas a cualquier edad
- Dos o más familiares (≤ 50 años) con cáncer de mama
- Tres o más familiares con cáncer de mama a cualquier edad
- Una mutación BRCA1 o BRCA 2 previamente identificada en la familia
- Antecedentes personales de cáncer de mama entre los 46 y 50 años y un familiar cercano con cáncer de mama, ovario, páncreas o próstata.
- Antecedentes personales de cáncer de mama a cualquier edad y un familiar cercano con cáncer de mama a los 50 años o menos, o dos o más familiares cercanos con cáncer de mama a cualquier edad.
- Cáncer de próstata metastásico a cualquier edad
Las personas que heredan tales mutaciones se enfrentan a un alto riesgo de desarrollar cáncer de mama durante su vida. Una vez diagnosticadas con cáncer de mama invasivo, tienen más riesgo en desarrollar un segundo cáncer de mama ipsolateral o contralateral [4].
Por lo tanto, un diagnostico correcto de la presencia de tales mutaciones de la línea germinal combinado con estrategias adecuadas de prevención y detección son de suma importancia para combatir dicha enfermedad.
Magtrace® trazador linfático para ganglios linfáticos centinela de detección
Muchos tratamientos de cáncer involucran la biopsia del gánglio linfático centinela. Los ganlios centinela son los primeros ganglios que drenan y, por lo tanto, tienen mayor potencial de albergar metástasis. Su extracción y análisis son esenciales para determinar el estadio ganglionar del cáncer, lo que permite un plan de tratamiento individual para el paciente.
El trazador paramagnético Magtrace® es un trazador líquido que ha sido desarrollado específicamente para el procedimiento de BSGC que se lleva a cabo al mismo tiempo que se extrae el tejido sospechoso de cáncer en la mama.
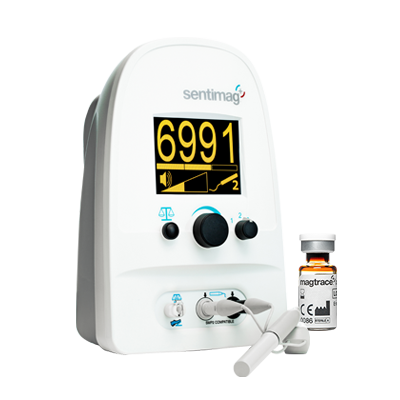
Para ayudar a identificar los ganglios centinela, el marcador se inyecta en la mama y migrará a través del sistema linfático hasta los ganglios centinela [5]. Con su señal rastreable, los nodos que contienen Magtrace® pueden identificarse usando el sensor magnético en la sonda Sentimag® antes de ser removidos para determinar la propagación del cáncer.
Extirpación de las lesiones no palpables en la mama con Magseed®
Tras la detección de un cáncer de mama en estadio temprano o un bulto sospechoso, la cirugia conservadora puede ser una opción, esta es tambien conocida como tumorectomía o mastectomía parcial.
Se trata de un procedimiento quirúrgico que tiene como objetivo eliminar por completo la lesión y un pequeño margen de tejido sano a su alrededor para garentizar que no queden células tumorales, mientras se conserva la mayor cantidad de tejido sano posible.
Para localizar exactamente la lesión durante la cirugía, existen algunas ayudas que se utilizan como marcadores; Magseed® es una de ellas.
Antes de la cirugía, Magseed® se coloca en el centro de la lesión con guía por rayos X o ultrasonido. La colocación se puede programar cuando sea conveniente para el paciente y el personal del hospital. Posteriormente, esta minúscula semilla de tan solo 1x5 mm de tamaño permanece fija en su lugar sin causar molestias a la paciente hasta el día de la cirugía [6].
Durante la cirugía, el sistema Sentimag® es utilizado para localizar exactamente la semilla Magseed® y de este modo, encontrar la lesión, ya que es donde se encuentra Magseed®. Esto permite extirpar el tumor de forma precisa y completa.
Vea el video con la radióloga Dra. Marie-Rose El Bejjani del Hospital Saint-Joseph en París y obtenga más información sobre la colocación con Sentimag®-Magseed®.
Vea el video con la cirujana de mama Dra. Severine Alran del Hospital Saint-Joseph en París y obtenga más información sobre la cirugía con Sentimag®-Magtrace®.
Disección axilar dirigida con Sentimag® - Magtrace® /Magseed®
En algunos casos, el plan de tratamiento del cáncer de mama incluye la quimioterapia neoadyuvante, consiste en la administración de quimioterapia antes de la cirugía. Esto permite monitorizar de cerca la respuesta y, de acuerdo con los estudios, el tumor en la mama puede llegar a reducirse y los ganglios linfáticos con células tumorales pueden pasar de “positivos” a negativos”. Lo que se traduce en un aumento de las posibilidades de recibir posteriormente un abordaje quirúrgico menos invasivo, por ejemplo, cirugía conservadora de mama.
Si se detectan ganglios linfáticos sospechosos en la axila en el momento del diagnóstico, generalmente se marcan antes o durante la quimioterapia neoadyuvante. Para ello, se puede insertar un marcador Magseed® en los ganglios linfáticos sospechosos, lo que garantiza una identificación y extracción muy precisa durante la siguiente intervención, con la ayuda del detector Sentimag®.
Además, también se realiza una biopsia de ganglio centinela (BSGC) con el mismo equipo, para lo cual se inyecta el trazador Magtrace® en la mama, este migrará a los ganglios centinela. El sensor magnético de la sonda Sentimag® detectará la señal de las partículas Magtrace® e identificará los nodos asociados [7].
La combinación de estos dos procedimientos se denomina disección axilar dirigida (TAD). Este procedimiento se ha vuelto más común dado que los primeros estudios han demostrado que es más preciso para determinar el estado de la axila después de quimioterapia y evaluar si se ha conseguido disminuir o erradicar las células tumorales del paciente.
Manejo axilar después del tratamiento neoadyuvante
Sentigmag®-Magseed® / Magtrace® y OSNA
Manufacturer: Sentimag®, Magseed® and Magtrace® are manufactured by Endomagnetics Ltd (Endomag)
Sentimag® and Magseed® are registered European Union trademarks of Endomagnetics Ltd
Magtrace® is a registered trademark of Endomagnetics Ltd in the United Kingdom
Evaluación de los ganglios linfáticos con la técnica OSNA
El cáncer de mama generalmente se disemina primero a los ganglios linfáticos cercanos en la axila. Durante la cirugía, los ganglios linfáticos, conocidos como ganglios linfáticos centinela se extraen y se analizan para detectar la presencia de metástasis, este procedimiento se llama biopsia de ganglio linfático centinela.
Dependiendo de la extensión de la carga tumoral presente en el ganglio linfático (GC), el cirujano decide si es necesaria o no una disección adicional de los ganglios linfáticos axilares. Por lo tanto, un método preciso, confiable, y rápido para el análisis de los GC es de suma importancia en el manejo del cáncer de mama. El enfoque menos invasivo de la biopsia de ganglio linfático centinela permite evitar muchas disecciones axilares, mejorando la calidad de vida del paciente.
OSNA es una técnica de diagnóstico de base molecular de vanguardia de alta sensibilidad para la estadificación precisa y rápida de los ganglios linfáticos que revela la imagen ganglionar completa. Su valor clínico va más allá de la mera evaluación de los ganglios linfáticos, ya que respalda las decisiones de tratamiento personalizadas y mejora la calidad de vida del paciente.
Mire el video con el Dr. Vicente Peg del Hospital Universitario Vall d’Hebron, Barcelona, y aprenda más sobre la estadificación intraoperatoria molecular de los ganglios linfáticos con OSNA.
Vea el video con el Dr. Vicente Peg del Hospital Universitario Vall d'Hebron, Barcelona, y aprenda más sobre la estadificación intraoperatoria molecular de los ganglios linfáticos con OSNA.
Diagnóstico de precisión para la selección de terapias dirigidas en el cáncer de mama
Los diagnósticos de precisión son la clave para seleccionar la terapia adecuada en el momento adecuado para el paciente con cáncer.
Las alteraciones genéticas juegan un papel crucial durante la aparición y desarrollo del cáncer de mama. Por lo tanto, la evaluación confiable del estado mutacional del tumor es decisiva, no solo para seleccionar a los pacientes con cáncer elegibles para la terapia dirigida, sino que también para monitorizar la respuesta al tratamiento y a la progresión de la enfermedad.
Hoy en día se encuentra disponible una gran variedad de fármacos dirigidos a alteraciones genéticas específicas de tumores, que pueden ser recetados en lugar de, o en combinación con, quimioterapias, inmunoterapias y radioterapias estándares.
La amplificación de HER2 se observa en aproximadamente el 15% de los cánceres de mama y, en ausencia de tratamiento, se asocia con un pronóstico precario [8,9]. Se ha demostrado que el tratamiento de pacientes con amplificación de HER2 con el anticuerpo monoclonal Herceptin® (Trastuzumab) es eficaz, aumentando el tiempo de supervivencia global [10,11].
Además, se ha demostrado que el gen FGFR1 se amplifica en aproximadamente el 10% de los pacientes con cáncer de mama. Indica un resultado desfavorable, ya que la sobreexpresión del producto génico se ha implicado en la recaída temprana [12-14].
La amplificación del gen TOP2A también se observa en el cáncer de mama, frecuentemente con co-amplificación de HER2 [15,16]. Las aberraciones del gen TOP2A son un marcador de la respuesta a la quimioterapia basada en antraciclinas en pacientes con cáncer de mama [12].
Para investigar tales cambios genéticos, los oncólogos pueden hacer uso de varias pruebas genéticas moleculares que pueden ayudarlos a tomar decisiones de tratamiento personalizadas. Sysmex ofrece una gama de productos basados en tecnologías de biología molecular de vanguardia, que brindan apoyo a los profesionales de la salud y a los pacientes a lo largo de toda la vía de atención.
Selección de terapia
Con las sondas CytoCell® FISH (Fluorescence In Situ Hybridisation) * para los genes HER2 (ERBB2), FGFR1, TOP2A, MET, EGFR y RB1, los oncólogos obtendrán información específica sobre genes clave que pueden administrarse fármacos y marcadores de pronóstico.
Descárgate el brochure de las sondas CytoCell pathology para breast cancer
Otros genes de cáncer de mama concurrentes, incluyendo, BRCA1, BRCA2, TP53 y PIK3CA pueden ser estudiados a partir de los kits NGS – la solución Sysmex –SureSeqTM myPanelTM* NGS Custom Breast Cancer Panel.
Para más información, visite SureSeq myPanel NGS Custom Breast Cancer Panel website
Descárgate the SureSeq Breast Cancer + CNV Panel brochure
* CytoCell® FISH probes: For laboratory professional use only. Not intended for use as stand-alone diagnostics or companion diagnostics. Therapeutic action should not be initiated on the basis of the FISH result alone.
* SureSeqTM myPanelTM: For Research Use Only. Not for use in diagnostic procedures.
Manufacturer and Trademarks: CytoCell® FISH Probes (Cytocell Limited), SureSeqTM myPanelTM (Oxford Gene Technology IP Limited)
Seguimiento de la terapia y la recurrencia
A pesar del tratamiento primario quirúrgico y/o sistémico, hasta el 30% de los pacientes con cáncer de mama todavía se enfrentan a la progresión de la enfermedad. Así pues, monitorizar a los pacientes para detectar la respuesta a la terapia, particularmente las mutaciones de resistencia y la recurrencia del tumor, es de vital importancia para asegurar el mejor resultado posible a largo plazo para el paciente.
En la oncología personalizada moderna, ciertas alteraciones genéticas somáticas han surgido como biomarcadores clave para la progresión de la enfermedad, que son detectables en el ADN del tejido tumoral o en el ADN derivado del tumor (ADNc) circulante detectado en una biopsia líquida. En la etapa de monitorización, las muestras de tejido a menudo no están disponibles para su análisis. Sin embargo, las biopsias líquidas se pueden muestrear repetidamente con una angustia mínima del paciente y se ha demostrado que superan las limitaciones de las biopsias de tejido, como la falta de heterogeneidad tumoral, la accesibilidad de la muestra inferior y el tiempo de respuesta prolongado.
Por lo tanto, la detección de mutaciones clínicamente relevantes a partir de una simple extracción de sangre permite a los oncólogos seleccionar la terapia más beneficiosa y monitorizar la respuesta del paciente a la terapia en tiempo real.
Los Plasma-SeqSensei™ (PSS) RUO son kits de nueva generación basados en secuenciación (NGS) y destinados a la investigación de mutaciones procesables relevantes en cáncer colorrectal, NSCLC, mama y tiroides, así como melanoma. Creados sobre la tecnología SafeSEQ ultrasensible, el portafolio del kit PSS RUO tiene como objetivo establecer un nuevo estándar para la determinación absoluta de moléculas mutantes (MM) independiente de la entrada de ADN de muestra real, ofreciendo así a los investigadores una herramienta de vanguardia para avanzar en la oncología personalizada. Debido a su capacidad para determinar frecuencias de alelos variantes bajas, es especialmente útil para la detección de enfermedades residuales mínimas (MRD) y otras aplicaciones que requieren medición secuencial como respuesta, recurrencia o monitorización de resistencia.
Obtenga más información sobre cómo Sysmex marca la diferencia en la lucha contra el cáncer de mama
Sigue explorando
Referencias
- Sung H. et al. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin., 71(3):209-249.
- Paluch-Shimon S. et al. (2016). Prevention and screening in BRCA mutation carriers and other breast/ovarian hereditary cancer syndromes: ESMO Clinical Practice Guidelines. Ann Oncol., 27 (5): v103-v110.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast and Ovarian. V3.
- Kotsopoulos J. (2018). BRCA Mutations and Breast Cancer Prevention. Cancers, 10(12), 524.
- Pedro L. et al. (2019): Impact of locally administered carboxydextran-coated super-paramagnetic iron nanoparticles on cellular immune function. Small, 15, 1900224.
- Kühn F. et al. (2020): A German study comparing standard wire localization with magnetic seed localization of non-palpable breast lesions. In vivo, 34, 1159-64.
- Pohlodek K. et al. (2019): Localization of impalpable breast lesions and detection of sentinel lymph nodes through magnetic methods. Eur. J. Radiol., 120, 108699.
- Tsai-Pflugfelder M, et al. Proc Nat Acad Sci 1988;85:7177-81.
- Bofin AM, et al. Cytopath 2003;14(6):314-9.
- Fountzilas G, et al. BMC Cancer 2013;13:163.
- O’Malley, et al. J Natl Cancer Inst 2009;101(9):644-650.
- Letessier A, et al. BMC Cancer 2006, 6:245.
- Courjal F et al., Cancer Res 1997;57(19):4360-7
- Turner N et al., Cancer Res 2010;70(5):2085-94
- Bofin AM, et al. Cytopath 2003;14(6):314-9.
- Fountzilas G, et al. BMC Cancer 2013;13:163