Calendario científico octubre de 2024
Control del TAPD utilizando ALT
¿Cómo utilizar la agregometría por transmisión de luz (ATL) para el control eficaz del tratamiento antiagregante plaquetario doble (TAPD)?
Determinando la agregación plaquetaria máxima en % a partir de la concentración de un único agonista del ácido araquidónico
Determinando el TP en INR
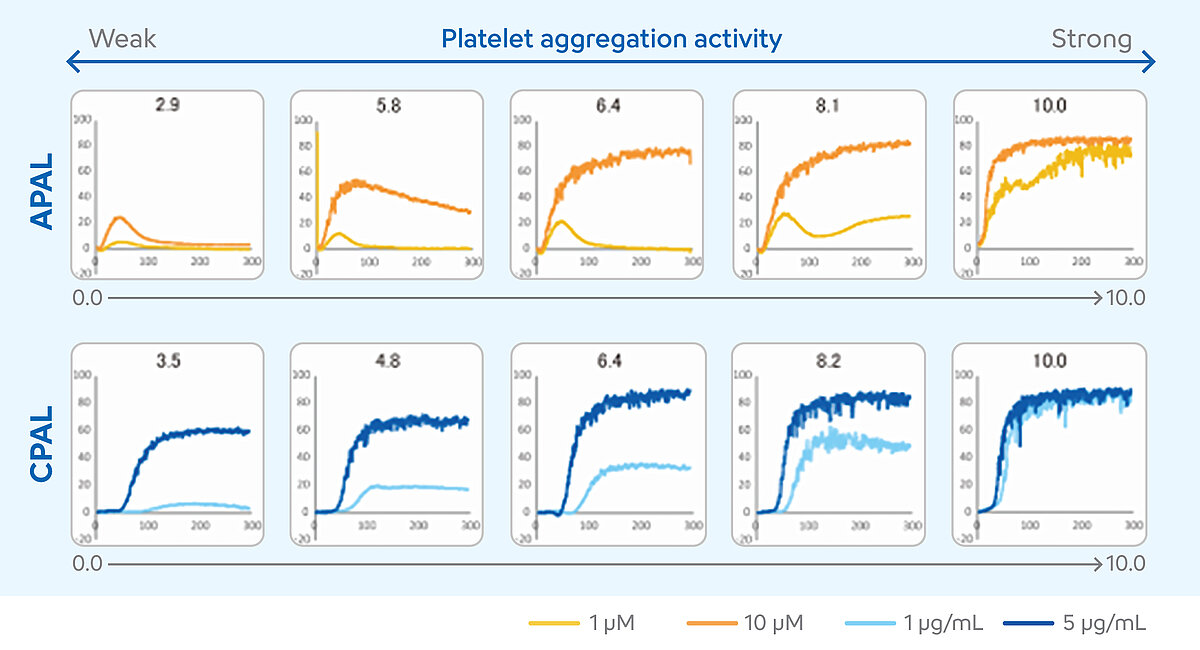
Determinando las puntuaciones APAL y CPAL
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Fundamentación científica
Actualmente, son muchas las herramientas de que se dispone para evaluar la función plaquetaria. El método más establecido y conocido es la agregometría por transmisión de luz (ATL) de Born. Este método de medición se desarrolló en 1963 y es el método de referencia para las investigaciones sobre trastornos plaquetarios congénitos. [1, 2] La medición se basa en un cambio en la transmisión de la luz del plasma rico en plaquetas debido a la activación plaquetaria y a la agregación provocada por la adición de un agonista plaquetario. [1] Aunque las guías la limitan a fines de investigación únicamente, la ALT también se puede utilizar para controlar el tratamiento antiagregante plaquetario. [3]
El tratamiento antiagregante plaquetario doble con clopidogrel u otro inhibidor del receptor plaquetario P2Y12 y aspirina ha demostrado ser una estrategia de tratamiento establecida y recomendada por las guías para pacientes con enfermedades cardiovasculares. Se sabe que el efecto farmacológico de los antiagregantes plaquetarios varía de una persona a otra. Se ha informado de que muchas personas no responden al clopidogrel debido a polimorfismos genéticos CYP2C19. [4–6] El efecto antiagregante plaquetario de la aspirina es reducido en los pacientes que presentan lo que se conoce como «resistencia a la aspirina» debido a polimorfismos mononucleotídicos (SNP) que afectan a la COX-1 y a la función plaquetaria, inflamación y síndrome metabólico. [7–9]
En los últimos años, la ALT se ha vuelto más estandarizada gracias a los analizadores de coagulación totalmente automatizados de las series CS (excl. CS-1600) y CN (todos de Sysmex Corporation, Kobe, Japón) que reducen la intervención manual del operador y mejoran significativamente la precisión y la repetibilidad de los resultados.
Tabla 1 ALT utilizando un analizador semiautomático comparado con analizadores de las series CS y CN
| Semiautomático | Pasos del procedimiento | Series CN/CS |
| Manual | Extracción y preparación de la muestra de sangre | Manual |
| Manual | Preparación de la cubeta de agitación | Minimizado |
| Manual | Dispensación de la muestra | Automatizado |
| Manual | Dilución del agonista | Automatizado* |
| Manual | Dispensación del agonista | Automatizado |
| Automatizado | Detección de la agregación | Automatizado |
| Automatizado | Obtención del resultado | Automatizado |
* Solo la serie CN
La interpretación de los resultados de la medición por ALT requiere un alto nivel de conocimiento. En la evaluación de casos individuales deben incluirse diversos resultados numéricos y la progresión de la curva. En los últimos años, estos requisitos han limitado el uso de la ALT en el control del tratamiento antiagregante plaquetario doble (TAPD). Para resolver este problema y facilitar la interpretación de los resultados, se desarrolló el método de las concentraciones de dos agonistas para los analizadores de las series CS y CN. [10] En este método, se miden las muestras de los pacientes con dos concentraciones de aspirina y un agonista sensible al inhibidor de P2Y12. Los resultados de las dos concentraciones se traducen en una puntuación: el nivel de agregación plaquetaria (PAL). La puntuación se puede utilizar para estimar si el TAPD es suficientemente eficaz o si el paciente necesita, quizá, un ajuste del tratamiento. La PAL es una función adicional del analizador y utiliza los agonistas plaquetarios ADP como agonista sensible al inhibidor de P2Y12 y colágeno como agonista sensible a la aspirina. La PAL inducida por ADP (APAL) se calcula a partir de los resultados de las mediciones de una concentración de 1 µM y 10 µM, y la PAL inducida por colágeno (CPAL), a partir de los resultados en una concentración de 1 µg/ml y 5 µg/ml. Tanto APAL como CPAl se calculan utilizando el área bajo la curva (ABC). [11-13]
Las puntuaciones varían entre 0 y 10. Unos valores más altos de PAL indican mayores niveles de agregación plaquetaria, lo que sugiere una respuesta escasa o nula al TAPD, mientras que unos valores más bajos de PAL indican niveles más bajos de agregación plaquetaria, lo que sugiere una respuesta adecuada al TAPD. [14]
Los estudios acerca de las puntuaciones PAL en los analizadores de las series CS y CN revelaron una imprecisión por debajo del 5 % en las muestras con adición de aspirina (CPAL) o adición del inhibidor de P2Y12 cangrelor (APAL) en un analizador de la serie CN, y por debajo del 10 % en las muestras con adición de cangrelor (APAL) y por debajo del 5 % en las muestras con adición de aspirina (CPAL) en un analizador CS-5100. Los resultados de PAL muestran una buena correlación entre ambas series de analizadores, como se muestra en la tabla 2. [14, 15]
Tabla 2 Correlación entre CN-6000 y CS-5100
| AGONISTA | CONCENTRACIÓN | N | COEFFICIENTE R | |
| ADP | 1 µM | 85 | 0,988 | y = 1,00x + 3,85 |
| 10 µM | 85 | 0,955 | y = 0,89x + 11,44 | |
| Puntuación de APAL | 85 | 0,971 | y = 0,91x + 0,94 | |
| COLÁGENO | 1 µg/mL | 82 | 0,996 | y = 1,02x - 0,83 |
| 5 µg/mL | 82 | 0,972 | y = 0,99x + 0,66 | |
| Puntuación de CPAL | 82 | 0,994 | y = 1,00x - 0,08 |
Otros estudios han demostrado una mejora de la sensibilidad del sistema PAL en comparación con el uso convencional de ALT sin sistema de puntuación. Se observó que la puntuación PAL reducía la variabilidad en la misma persona y resultó ser más fiable para medir la eficacia de los antiagregantes plaquetarios que la máxima agregación plaquetaria en % en una concentración con un único agonista. [16]
Hay más estudios en curso actualmente para establecer valores de corte para el control del tratamiento antiagregante plaquetario utilizando la puntuación PAL, que reducirá significativamente en el caso ideal, la recidiva de episodios trombóticos durante el tratamiento.
Bibliografía
[1] Born GV. (1962): Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature. 194: 927–929.
[2] Kang J, Park KW, Palmerini T, et al. (2019): Racial Differences in Ischaemia/Bleeding Risk Trade-Off during Anti-Platelet Therapy: Individual Patient Level Landmark Meta-Analysis from Seven RCTs. Thromb Haemost. 119 (1): 149–162.
[3] Cattaneo M, Cerletti C, Harrison P, Hayward CPM, Kenny D, Nugent D, Nurden P, Rao AK, Schmaier AH, Watson SP, Lussana F, Pugliano MT, Michelson AD. (2013): Recommendations for the standardization of light transmission aggregometry: a consensus of the working party from the platelet physiology subcommittee of SSC/ISTH. J Thromb Haemost; 11:1183–1189.
[4] Cattaneo M. (2010): New P2Y(12) inhibitors. Circulation. 121 (1): 171–179.
[5] Bonello L, Tantry US, Marcucci R, et al. (2010): Consensus and future directions on the definition of high on-treatment platelet reactivity to adenosine diphosphate. J Am Coll Cardiol. 56 (12): 919–933.
[6] Tantry US, Bonello L, Aradi D, et al. (2013): Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding. J Am Coll Cardiol. 62 (24): 2261–2273.
[7] Colantonio LD, Gamboa CM, Kleindorfer DO, et al. (2016): Stroke symptoms and risk for incident coronary heart disease in the REasons for Geographic And Racial Differences in Stroke (REGARDS) study. Int J Cardiol. 220: 122–128.
[8] Cattaneo M. (2007): Resistance to antiplatelet drugs: molecular mechanisms and laboratory detection. J Thromb Haemost. 5, Suppl 1: 230–237.
[9] Cattaneo M. (2004): Aspirin and clopidogrel: efficacy, safety, and the issue of drug resistance. Arterioscler Thromb Vasc Biol. 24 (11): 1980–1987.
[10] Matsuo T, Ohki Y. (1977): Classification of platelet aggregation patterns with two ADP solutions (the double-ADP method) and its clinical application to diabetes mellitus. Thromb Res. 11 (4): 453– 461.
[11] Sakayori T, Watanabe Y, Kitano K, et al. (2019): Evaluating the Utility of a Novel Research Use Index in Platelet Aggregation Analysis Featured in an Automated Blood Coagulation Analyzer to Confirm the Effect of Antiplatelet Drugs. Sysmex J Int. 2019; 29 (1): 39–47.
[12] Omori Y, Ishida H, Sakayori T, et al. (2019): Evaluation of Fully Automated Blood Coagulation Analyzer Equipped with a Novel Analysis Method – Antiplatelet Responsive Index –. Rinsho Byori. 67 (3): 205–211.
[13] Sadakata T, Sakayori T, Watanabe Y, et al. (2018): Basic Evaluation of PAL Which is a Research Use Index for Confirming the Effect of Antiplatelet Drugs Installed in the CS Series and Comparison Study with the Index Installed in Existing Instrument. Sysmex J. 2018; 19 (2): 1–10.
[14] Sakayori T, et al. (2024): Analytical Evaluation of Platelet Aggregation Level on a Fully Automated Coagulation Analyzer CN-6000, and a Case Study of an Initial Absorbance of Platelet-rich Plasma. Sysmex Journal International Volume 34 No.1. Published 12 June 2024.
[15] Shimizu M, et al. (2019): Evaluation of a new analysis index of platelet aggregation test using CS-5100 with G-Type on a PRP313M. Japanese Journal of Medical Technology, Volume 68, Issue 3, Pages 501–506.
[16] Lecchi A, Capecchi M, Padovan L, Artoni A, Arai N, Shinohara S, La Marca S, Peyvandi F. (2024): Evaluation of an automated platelet aggregation method for detection of congenital or acquired platelet function defects. Blood Transfus. 22(4):350–359.